疱疹病毒分子生物学
人巨细胞病毒(HCMV)是一种在人群中普遍感染的机会性病原体。该病毒在感染者体内长期潜伏,并时常复发。HCMV感染在健康成人中一般不引起疾病,但它是造成新生儿听力、视力丧失以及智障的首要病因之一。在免疫缺陷病人(比如艾滋病患者、器官移植病人以及接受放化疗的肿瘤患者)中,HCMV感染会引起严重的并发症,可引起器官移植失败或者肿瘤病人死亡。最新的研究进展表明HCMV感染还与心血管疾病以及某些恶性肿瘤的发生相关。
HCMV基因组大约编码166个病毒蛋白,其中50%左右的蛋白质功能未知。本课题组从解析病毒基因功能入手,着重研究其调控病毒与宿主间相互作用的分子机制。在与宿主长期的共同进化过程中,病毒基因演化出了精细调控细胞内信号通路的能力。因此,病毒基因功能研究一直都是研究重要的细胞分子生物学和免疫学问题的有力工具。本课题组对病毒基因与宿主细胞相互作用的研究不仅将阐明病毒基因促进病毒复制的分子机制,为抗HCMV感染药物研发提供新的靶位和思路,还极有可能揭示新的细胞分子生物学和免疫学原理。目前正在开展的部分工作和进展列举如下:
1. 研究巨细胞病毒蛋白pUL38激活mTORC1和抑制细胞凋亡的分子机制
pUL38缺失的HCMV病毒几乎不能复制。研究表明pUL38是一个多功能蛋白质,它激活mTORC1、抑制细胞凋亡并促进病毒复制。在分子水平,pUL38与抑癌基因TSC2编码的蛋白质tuberin相互作用,但是这一相互作用与pUL38抑制细胞凋亡的功能不相关,也不能完全解释其激活mTORC1的功能。我们刚发表的工作(J Virol. 2015 May 13. doi:10.1128/JVI.01027-15.)鉴定了pUL38和TSC2相互作用的关键氨基酸基序,该基序突变的pUL38不能与TSC2相互作用,但依然能激活mTORC1。本研究工作表明病毒蛋白pUL38可以利用不依赖于TSC2的细胞内信号通路激活mTORC1,具体的分子机制正在解析过程中。另外我们通过免疫亲和层析结合串联质谱分析,鉴定了一个新的与pUL38相互作用的宿主蛋白,利用RNA干扰抑制该宿主蛋白表达可以阻断pUL38缺失病毒感染引起的细胞凋亡,表明pUL38结合并抑制该宿主蛋白的功能从而抑制细胞凋亡。我们将进一步深入研究其分子机制。
2. 研究干扰素诱导跨膜蛋白(IFITM)促进巨细胞病毒复制的分子机制
干扰素诱导跨膜蛋白(IFITM)广谱抑制多种RNA病毒如艾滋病病毒、流感病毒及埃博拉病毒对宿主细胞的入侵。我们应用荧光共聚焦显微镜和电镜观察并结合分子细胞生物学技术发现IFITM不仅不抑制HCMV感染,而且被HCMV利用促进其病毒组装中心的形成(J Virol. 2015 Mar;89(6):3049-61)。本工作首次研究了IFITM在DNA病毒复制中的作用机制,发现HCMV把一类经典的干扰素诱导的抗病毒分子变为辅助其复制的宿主因子。后续机制研究正在进行中。
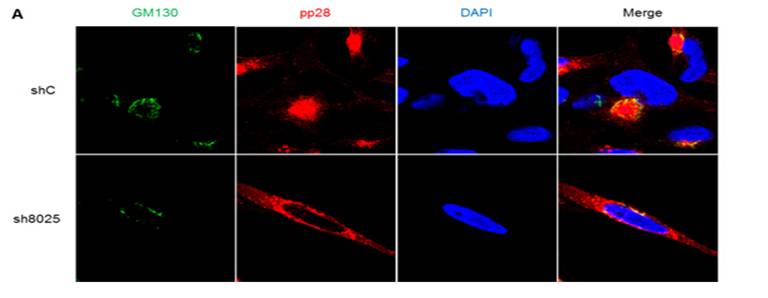
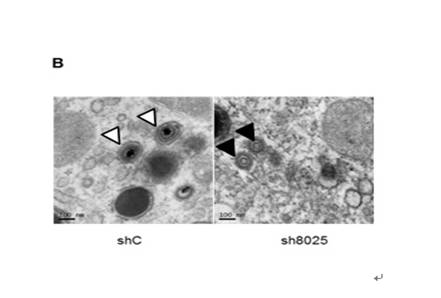
图:RNAi下调IFITMs影响病毒组装。A. shRNA 下调IFITMs影响病毒组装中心结构的形成。上图:在对照shRNA(shC)维持IFITMs表达情况下,病毒结构蛋白pp28在靠近细胞核外侧形成球形结构,高尔基体标志物GM130则形成环形结构围绕pp28,两者显示典型的病毒组装中心结构。 下图:在sh8025下调IFITMs时,GM130和pp28的分布没有聚集成病毒组装中心结构。B. shRNA 下调IFITMs影响病毒颗粒包装。左图:IFITMs正常表达时病毒(白色箭头)组装成熟。右图:IFITMs下调后病毒没有完成包膜(黑色箭头)。
3. 建立针对HCMV的高通量小分子药物筛选平台
利用基于细胞水平的高内涵筛选平台,我们测试了600多种已知靶位的小分子化合物抑制HCMV复制的能力,发现了多个有望开发成为抗HCMV感染药物的小分子化合物,并对其中一个化合物的抗病毒机制进行了初步研究(Journal of Medical Virology 2015,已接受)。对另一类化合物的抗病毒机制的研究正在进行中。通过二代测序(next generation sequencing,NGS)和生物信息学分析,我们发现了该类化合物抑制病毒复制的细胞通路。有意思的是,该通路与化合物已知的作用靶位无关,因此本工作有望揭示该化合物发挥作用的一种全新机制。筛选发现的其他小分子化合物抑制HCMV复制的机制还有待研究。