孟广勋组发现NLRP3炎症小体重塑菌群诱导调节性T细胞维持肠道稳态
12月1日,国际著名学术期刊Nature Communications以Article形式发表了中国科学院上海巴斯德研究所孟广勋课题组的最新研究成果,题为“Remodelling of the gut microbiota by hyperactive NLRP3 induces regulatory T cells to maintain homeostasis”(高活性NLRP3炎症小体通过重塑肠道菌群进而调节性T细胞维持肠道稳态)。
炎症小体是近年发现的位于细胞质的一类多蛋白复合物,它能够介导多种促炎信号,包括炎症因子白介素(IL)-1β,IL-18的成熟,以及切割促焦亡蛋白Gasdermin D。越来越多的证据表明炎症小体在肠道疾病发生以及维持肠道稳态的过程中扮演着重要的角色。在众多不同的炎症小体中,NLRP3炎症小体以其复杂的激活机制和显著的临床相关性而备受关注,但其在肠道生理中的作用机理目前仍不清楚。人的NLRP3基因位点上的功能获得性突变(如NLRP3-R260W)会导致一类叫做冷热相关周期性综合症(cryopyrin-associated periodic syndromes, CAPS)的自发炎性疾病。NLRP3-R258W小鼠模拟了NLRP3-R260W病人皮肤等处的炎症,但是在这些小鼠中,肠道部位却无任何炎性疾病的表现。这一现象提示NLRP3在肠道存在未被揭示的作用机理,使其在高活性的状态下仍能够维持肠道稳态。
上海巴斯德所硕博研究生姚小敏和邢跃在孟广勋研究员的指导下,与上海交通大学生命学院赵立平教授实验室合作发现NLRP3-R258W 突变不仅没有造成肠道的自发炎症,反而增强了小鼠对肠炎和肠癌的抵御能力。原因是NLRP3-R258W能够重塑肠道菌群,让其变得具有更简单的动态网络结构以及更多的能够诱导调节性T细胞的细菌。上调的调节性T细胞对宿主约束肠道炎症反应起了关键作用,因为去除/抑制调节性T细胞后NLRP3-R258W小鼠不仅失去对肠炎的保护作用,甚至发生肠道的自发炎症。机制研究表明,在肠道固有层单核吞噬细胞中突变的NLRP3通过分泌更多的IL-1β 而非IL-18来促进肠道局部上皮的抗菌肽的分泌,从而导致菌群的改变。该研究首次揭示了NLRP3炎症小体在肠道中的作用机理以及其通过与肠道菌群的互作来影响和维持肠道稳态的现象,这为治疗NLRP3炎性小体相关肠道疾病提供了理论基础。
该研究工作得到国家自然科学基金委、科技部和中国科学院的项目资助。
原文链接:https://www.nature.com/articles/s41467-017-01917-2
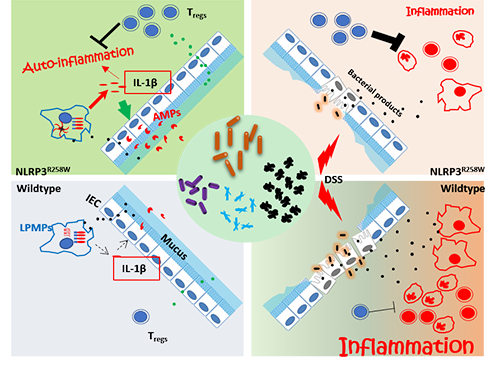
图:NLRP3炎症小体活性增强导致肠道菌群改变而诱导调节性T细胞维持肠道稳态