上海巴斯德所发现病毒利用宿主糖代谢改变传播途径实现免疫逃逸的新机制
2021年7月23日,国际学术期刊PLOSPathogens在线发表了中国科学院上海巴斯德研究所钟劲课题组的研究论文:Glycometabolism regulates hepatitis C virus release。

丙型肝炎病毒(hepatitisCvirus,HCV)是一种正链RNA病毒,可导致慢性肝炎,肝硬化和肝癌的发生。HCV的感染周期包括入胞、脱衣壳、基因组复制和翻译、病毒粒子组装和成熟以及释放等步骤。基于人肝癌细胞系Huh7及Huh7衍生细胞系建立的HCV细胞培养模型(HCVcc)为研究HCV完整感染周期提供了极大的帮助。
然而,由于代谢重编程的存在,肿瘤细胞和正常体细胞在糖代谢等一系列代谢通路上存在着明显差异。肿瘤细胞即使在有氧条件下,仍然使用糖酵解作为主要的能量来源,而不像正常体细胞那样主要使用氧化磷酸化来供能,这种现象叫做“瓦博格效应”。
以往多项研究发现,如果将培养基中的糖源从葡萄糖换为半乳糖,可以迫使体外培养的肿瘤细胞减弱糖酵解而转向以氧化磷酸化作为主要的供能方式。因此,利用半乳糖培养改变宿主细胞糖代谢的模型来研究HCV感染周期,对于探索HCV在体内的自然感染过程具有重要的指导意义。
在该项工作中,研究人员发现将Huh7细胞培养在以半乳糖作为糖源的培养基中,可以显著抑制HCV病毒粒子的释放,但不影响HCV的入胞、复制、组装和成熟。通过进一步的探索,研究人员发现在半乳糖培养条件下,大量的病毒粒子聚集在细胞内的多泡体(Multivesicular body)内而无法释放到细胞外。而阻断多泡体与溶酶体的融合或使用促炎细胞因子处理可以在一定程度上恢复半乳糖培养条件下HCV的释放。在机制方面,研究人员发现MAPK-p38通路在宿主细胞糖代谢对HCV释放的调控中发挥了重要的作用。
该研究还发现HCV在细胞与细胞间直接传播并不受宿主细胞糖代谢的影响,该发现表明HCV病毒粒子的释放和其在细胞与细胞间直接传播是两种在调控上相互独立的传播方式。根据以上研究结果,科研人员提出猜想,HCV在病人体内可能主要以细胞与细胞间直接传播为主,而不是通过释放到细胞外和血液中以感染邻近的细胞,并以此逃逸抗体的中和作用和宿主的免疫监视,这可能是HCV建立慢性持续感染的重要机制。该研究为深入理解细胞糖代谢与HCV释放的相互关系以及HCV自然感染过程提出了新的见解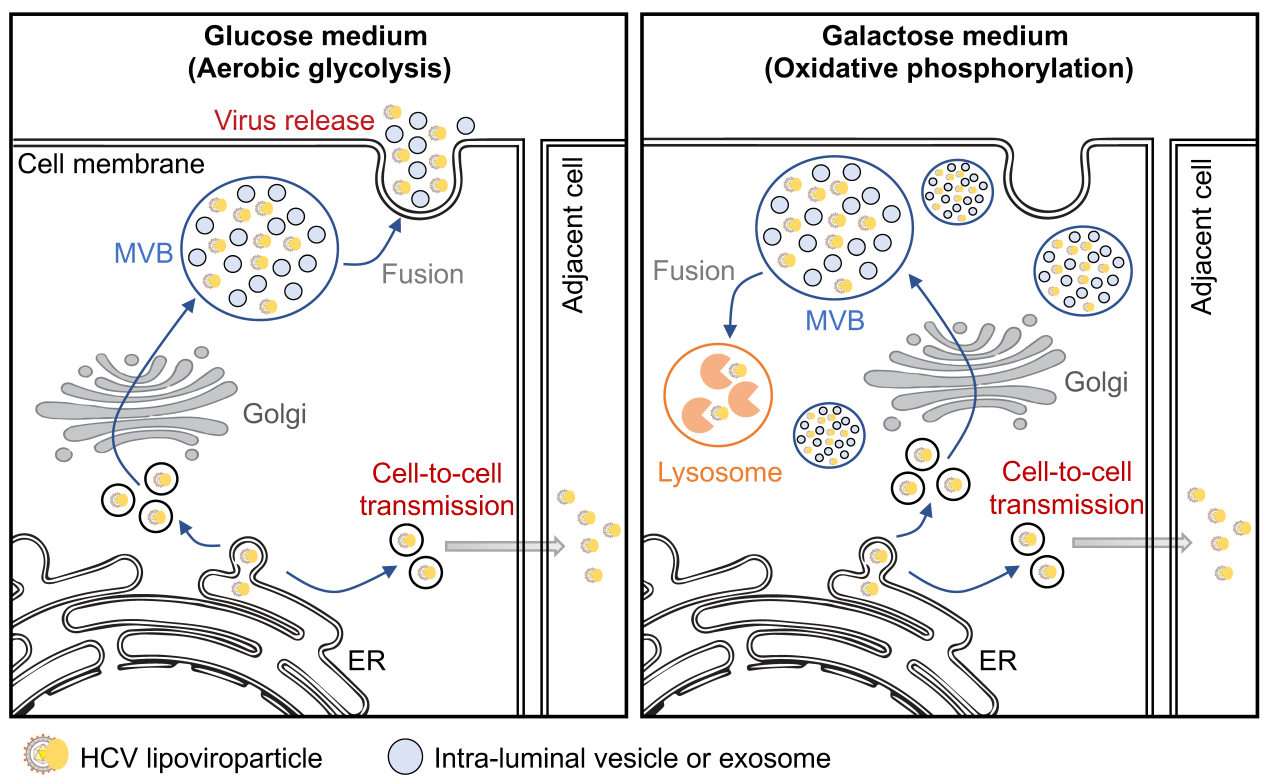
图注:糖代谢调节HCV释放的模式图
该项研究工作主要由上海巴斯德所于涛博士,博士研究生杨乾坤和田芳铃在钟劲研究员的指导下共同完成。中科院分子细胞科学卓越创新中心何勇宁课题组和上海巴斯德所酒亚明课题组合作参与了本项研究。该研究得到了中国科学院战略性先导科技专项(先导B)和国家自然科学基金的经费支持。
论文链接:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1009746