孟广勋组发现TRAF6参与介导NLRP3炎症小体激活
7月24日,国际免疫学经典期刊The Journal of Immunology以Cutting Edge形式发表了中国科学院上海巴斯德研究所孟广勋课题组的最新研究成果,题为“TRAF6 Mediates TLR/IL-1R Signaling-Induced Nontranscriptional Priming of the NLRP3 Inflammasome”(TRAF6通过不影响转录的方式介导TLR/IL-1R诱导的NLRP3炎症小体激活)。
炎症小体是宿主天然免疫细胞在受到病原微生物感染或损伤信号胁迫时出现的,由特定模式识别受体(pattern recognition receptors, PRRs)启动组装的多蛋白复合物。主要导致Caspase-1的激活以促进炎性细胞因子IL-1β、IL-18的成熟和分泌,并造成细胞焦亡(pyroptosis),从而有助于清除感染及修复损伤。目前能启动炎症小体形成的PRRs主要包括NOD样受体(nucleotide-binding oligomerization(NOD) like receptors, NLR)、AIM2样受体(AIM2-like receptor, ALRs)以及Pyrin。由于NLRP3参与多种感染性、自身炎性、自身免疫和代谢失调等疾病,对于NLR家族的NLRP3炎症小体目前研究最为广泛,但对于NLRP3炎症小体激活机制的认识目前仍处于初级阶段。NLRP3炎症小体激活需要两步信号刺激:信号1是通过toll样受体(Toll-like receptors,TLRs)等诱导的信号上调NLRP3蛋白水平并提供非转录依赖的启动信号;信号2则来源于包括ATP在内的多种刺激物,通过钾离子外流、线粒体损伤或溶酶体损伤等途径激活炎症小体。但目前的研究对于这两步信号(尤其是信号1)的具体分子机制仍然十分欠缺。
中科院上海巴斯德研究所硕博研究生邢跃和姚小敏在孟广勋研究员的指导下发现经典的TLR/IL-1R下游信号分子TRAF6(tumor necrosis factor (TNF) receptor–associated factor 6)参与NLRP3炎症小体的激活。实验结果证明在NLRP3炎症小体激活的过程中,TLR/IL-1R诱导的不依赖转录调节的启动信号需要TRAF6参与。在短时间TLR/IL-1R刺激诱导的快速激活NLRP3炎症小体模型中,TRAF6缺失抑制了Caspase-1激活、不依赖转录的IL-18分泌、ASC(Apoptosis-associated speck-like protein containing a CARD)聚合体的)形成以及细胞焦亡。进一步的机制研究发现TRAF6的缺失影响了NLRP3的寡聚以及NLRP3与ASC的相互作用,同时TRAF6介导NLRP3炎症小体的启动并不需要线粒体ROS参与,该过程依赖TRAF6的泛素E3连接酶活性却并不依赖Erk、Jnk和Syk的磷酸化激活。该研究进一步揭示了NLRP3炎症小体激活的分子机制,为治疗NLRP3炎性小体相关疾病提供了理论基础。
该研究工作得到国家自然科学基金委、科技部和中科院的项目资助。
原文链接:https://www.ncbi.nlm.nih.gov/pubmed/28739881
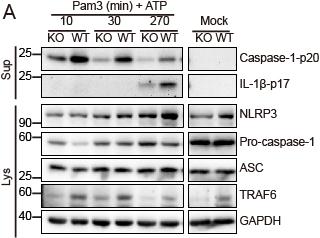
图A. 缺失TRAF6的巨噬细胞(KO)相比野生型细胞(WT)caspase-1-p20的分泌减少。
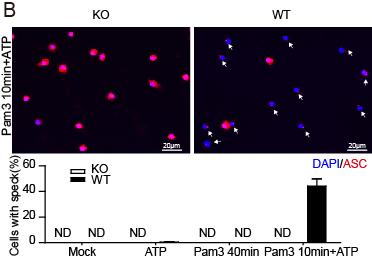
图A. 缺失TRAF6的巨噬细胞(KO)相比野生型细胞(WT)caspase-1-p20的分泌减少。
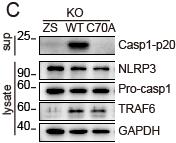
图C. 慢病毒回补实验说明激活炎症小体需要TRAF6泛素E3连接酶活性。