龙钢课题组建立HCV细胞感染可视化模型
11月16日,国际学术期刊Journal of virology
全球人口中有近2-3%的HCV感染者,同时HCV感染也是导致慢性肝炎、肝硬化、肝癌的主要病因之一。传统治疗方法为聚乙二醇干扰素与利巴韦林联合用药,但其治愈率不高。上市的新一代Direct antiviral agents(DAA)有较高的治愈率,但高昂的费用及可能的耐药性产生仍限制其广泛的使用,所以近期HCV的病毒学研究及疫苗的研发仍然是众多学者关注的焦点之一。
2010年Charles M Rice等建立的细胞感染模型HDFR system(HCV-dependent fluorescence relocation)首次实现在不修改HCV基因组的情况下实时监测HCV的病毒感染。该方法操作简单,直接通过观察荧光信号从细胞质转移到细胞核即可确定被感染细胞。但该方法有较强的荧光背景(细胞质荧光),特别在低MOI感染时很难快速找到感染细胞。
为消除上述方法的强荧光背景,方便实验者观察,上海巴斯德所研究助理赵凡凡和河南农业大学联合培养研究生赵婷在龙钢研究员的指导下,构建一种新型的细胞感染模型VISI system(viral infection activated split-intein mediated reporter system)。该方法首先将绿色荧光蛋白GFP在特定点分开,形成GFPn/GFPc两段,分别定位于细胞核内及线粒体上。一旦细胞被HCV感染,定位于线粒体上的GFPc会转移至细胞核内,在分离型内含肽(split-intein)的剪接作用下,GFPn/GFPc重新拼接形成完整GFP,从而显示荧光信号。因此细胞内无病毒感染时无荧光,有病毒感染时出现核荧光,低荧光背景和高信噪比极大的方便实验者的试验观察。利用VISI system,分别构建了VISI-GFP/VISI-mCherry两种不同荧光颜色的细胞系(donor cell/recipient cell),进一步研究了HCV的结构蛋白及宿主蛋白apoE在细胞间传播(cell to cell transmission)的作用。结果发现删除结构蛋白(core、
本文构建了一种新型高效特异的HCV感染细胞模型,不仅为HCV病毒学研究提供便利,同时为其他病毒的细胞模型建立提供新的思路。
该研究得到国家科技重大专项、973项目和国家重点研发计划等经费支持。
文章链接:http://jvi.asm.org/content/early/2016/11/10/JVI.01720-16.long
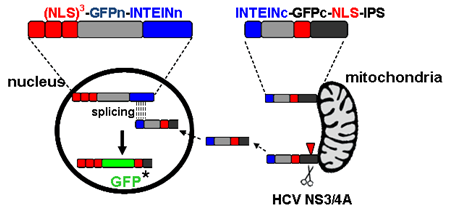
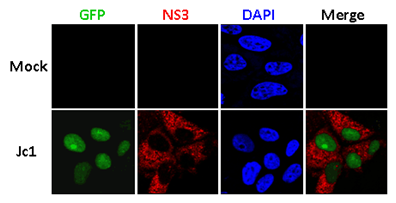
VISI system构建示意图及病毒感染后激发核荧光信号


VISI system应用于细胞间传播的模式图及HCV结构蛋白等基因的删除对细胞间传播的影响